
扫码体验VIP

扫码VIP小程序
系统提示:股票复盘网只提供基本的股票信息,如果需要了解实时、详细的股票行情数据,请登录VIP复盘网..
|
海思科
002653 |
2.71%
|
最新:47.76
开盘:46.51 昨收:46.5 |
开盘%:0.02%
振幅%:3.57% 换手%:0.57% |
最高:48.11
最低:46.45 量比:0.68 |
总市值:535 亿
流通值:256 亿 成交额:5 亿 |
- 基本信息
- 股票百科
- 个股快讯
- 上市公司
- 更多股票
- 专家分析
- 龙虎榜
- 历史涨停原因
- 董秘互动
- 分时图
- 日K图
- 周K图
- 月K图
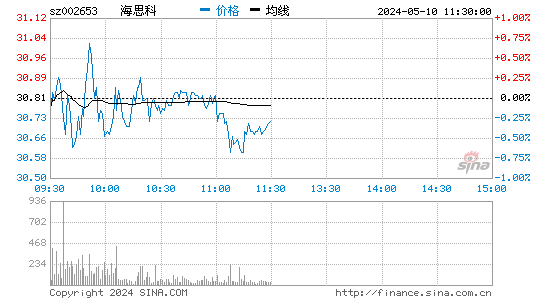
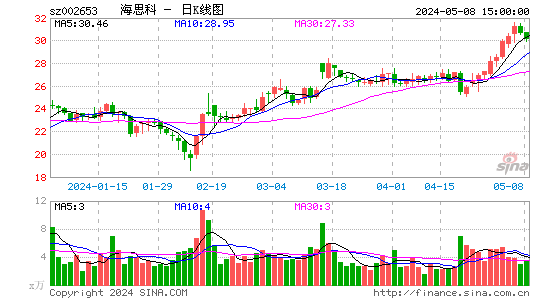
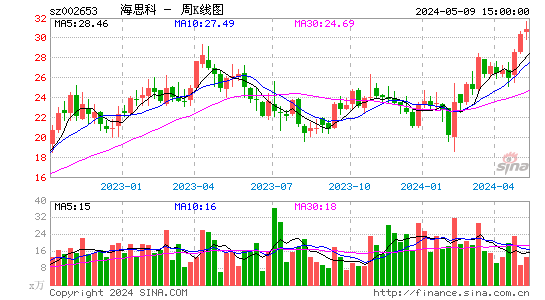
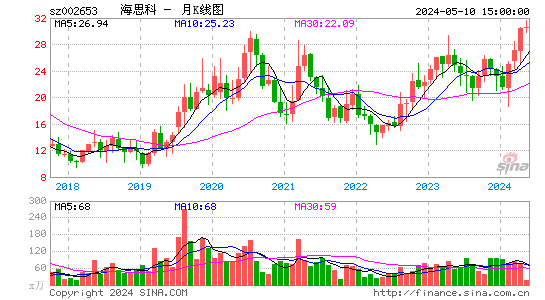
海思科股票概况
全面了解海思科及其股市表现
公司概况
海思科是一家专注于医药研发、生产和销售的高新技术企业。自成立以来,公司始终秉承创新理念,致力于开发具有自主知识产权的新药,以满足临床需求,提升患者生活质量。
业务领域
研发创新:海思科在多个治疗领域拥有深厚的研发实力,包括抗肿瘤、抗感染、神经系统疾病等。公司不断加大研发投入,推动新药研发进程。
生产制造:公司拥有先进的生产设施和严格的质量控制体系,确保产品的高质量和高安全性。
市场营销:海思科建立了覆盖全国的营销网络,通过专业的学术推广和客户服务,提升品牌影响力。
财务状况
近年来,海思科的财务状况稳健,营业收入和净利润持续增长。公司注重成本控制和资金管理,为未来发展奠定了坚实基础。
市场地位
作为医药行业的重要参与者,海思科凭借其创新能力和市场竞争力,在国内外市场上均占有一席之地。公司积极参与行业交流与合作,推动医药行业的健康发展。
总结
海思科作为一家具有创新精神的医药企业,在研发、生产和市场营销等方面均表现出色。其稳健的财务状况和显著的市场地位,使其成为股市中备受瞩目的投资标的。随着医药行业的持续发展,海思科有望迎来更加广阔的发展前景。
2025-07-15 20:43
【公告精选:泡泡玛特上半年溢利同比预增不低于350%;二连板楚天龙提示风险】7月15日电,【热点】二连板楚天龙:公司积极探索并推动数字货币桥落地场景等项目,但面临新技术研发及商业应用不达预期的风险。*ST亚振:股票交易异常波动,7月16日起停牌核查。【业绩】中际旭创:预计上半年净利润同比增长52.64%—86.57%。蓝海华腾:预计上半年净利润同比增长152.76%—190.68%。我武生物:上半年净利同比预增13.92%—23.97%。成都燃气业绩快报:上半年净利2.76亿元 同比增长0.91%。潞安环能:6月商品煤销量479万吨,同比减少1.64%。南网储能业绩快报:上半年净利8.02亿元 同比增长28.06%。思特威:上半年净利同比预增140%到180%。春秋航空:6月旅客周转量同比增长11.64%。泡泡玛特:预期截至2025年6月30日止六个月溢利较去年同期增长不低于350%。中煤能源:6月商品煤销量2165万吨,同比减少11.2%。光库科技:预计上半年净利润同比增长60%—80%。金力永磁:预计上半年净利润同比增长151%—180%。卫星化学:预计上半年净利润同比增长31.32%—53.2%。天宇股份:预计上半年净利润同比增长144.29%—238.25%。中国国航:6月平均客座率81.1%,同比上升1.1个百分点。麦趣尔:预计上半年净利润140万元—200万元,同比扭亏。凯盛新能:光伏玻璃毛利率下滑,预计上半年亏损4.35亿元到4.62亿元。炬芯科技:上半年净利润同比预增122.28%。康龙化成:预计上半年净利润同比下降36%—39%。中国太保:上半年两家子公司累计原保险业务收入2820.08亿元。华能国际:上半年境内完成上网电量2056.83亿千瓦时,同比下降2.37%。中国银河:上半年净利同比预增45%至55%。海能实业:上半年净利同比预增92%—122%。【增减持】方正科技:股东新方正控股拟减持不超2.27%公司股份。杭州银行:股东中国人寿拟减持不超0.7%公司股份。昂立教育:拟减持不超573.1万股回购股份。凌志软件:股东拟合计减持不超2.11%公司股份。浩云科技:董事长拟减持不超400万股公司股份。天元股份:控股股东、实控人的一致行动人及部分高管拟合计减持不超1%公司股份。三维天地:股东拟合计减持不超4.07%公司股份。【合同中标】中国西电:子公司合计中标国家电网13.24亿元采购项目。巨星科技:取得来自某欧洲大型零售业公司的订单中标通知。【重大投资】岩山科技:全资子公司参与设立合伙企业,将以股权形式最终投向Bytedance Ltd.。伯特利:拟与金鼎私募共同成立合伙企业 主要投资人形机器人等领域未上市企业股权。【股权变动】中晟高科:筹划公司控制权变更事项,股票明起停牌。【并购重组】*ST威尔:拟5.46亿元购买紫江新材51%股份,进入锂电池材料行业。中化国际:拟购买南通星辰100%股权,股票明起停牌。【再融资】远望谷:拟定增募资不超3亿元,用于RFID电子标签生产线建设项目等。【其他】三元生物:收到美国商务部赤藓糖醇反倾销调查初裁结果,公司适用450.64%反倾销税。东软集团:收到1320万元政府补助,占公司2024年度经审计归属于母公司股东的净利润20.94%。海思科:创新药HSK47388片获得美国FDA同意开展临床试验。东诚药业:江西宜春核药生产中心投入运营。大华股份:控股子公司华睿科技调整至香港联交所上市。西藏珠峰:控股股东塔城国际因涉嫌信息披露违法违规被立案。
2025-07-15 16:45
海思科:创新药HSK47388片获得FDA同意开展临床试验
2025-07-10 09:49
【创新药概念股反复活跃,联环药业、塞力医疗涨停】创新药概念股反复活跃,联环药业、塞力医疗、康辰药业涨停,海思科涨超7%,先达股份、华纳药厂、微芯生物纷纷上涨。
2025-07-07 12:10
【海思科:向特定对象发行股票申请获深交所受理】7月7日电,海思科(002653)7月7日午间公告,公司2025年度向特定对象发行股票申请获得深交所受理。
2025-07-01 18:05
海思科:获得创新药HSK45030分散片《药物临床试验批准通知书》
2025-06-24 20:12
【公告精选:盛新锂能拟4亿元—5亿元回购公司股份;金龙羽固态电池业务暂未形成长期稳定收入】6月24日电,【热点】5天4板中京电子:近期生产经营情况正常,无未披露重大事项。金龙羽:固态电池及其关键材料业务虽然目前已有订单,但暂未形成长期稳定收入。6天5板浙江东日:公司目前日常经营不涉及“脑机接口”业务。二连板顺灏股份:公司持有轨道辰光19.3%股份,未直接参与其日常经营管理。【业绩】广大特材:上半年净利润同比预增367.51%左右。泰凌微:上半年净利润同比预增267%左右。【回购】盛新锂能:拟4亿元—5亿元回购公司股份。智动力:拟3000万元—6000万元回购股份。【增减持】华翔股份:部分董监高拟合计减持不超0.1844%公司股份。腾龙股份:实控人之一致行动人拟减持不超3%公司股份。高凌信息:股东拟合计减持公司不超5.66%股份。苏奥传感:实控人拟减持公司不超3%股份。【合同中标】罗博特科:签订1710万欧元日常经营重大合同。【重大投资】新洋丰:拟11.5亿元投建新型作物专用肥项目。宝钛股份:拟2.87亿元以增资扩股方式取得万豪钛金51%股权。有研新材:子公司拟引入战投,国家集成电路产业投资基金二期投资总额为3亿元。西典新能:拟设立境外子公司及孙公司并建设泰国生产基地。立新能源:子公司拟5.29亿元投建奎屯市独立储能项目。伟测科技:拟在成都市投资不超过10亿元,主要用于设备购置、场地建设及土地购置等。耐普矿机:拟按持股比例出资约9459万美元投建Alacran铜金银矿项目。【并购重组】建龙微纳:筹划取得上海汉兴能源科技股份有限公司不少于51%股份。京东方A:拟以48.49亿元收购彩虹光电30%股权。【再融资】江苏雷利:拟发行可转债募资不超过12.86亿元。长川科技:拟定增募资不超31.32亿元,用于半导体设备研发项目等。【其他】海南橡胶:受台风“蝴蝶”影响,预计全年干胶减产约0.26万吨。大有能源:全资子公司孟津煤矿复工复产。大金重工:拟发行H股股票并在香港联交所主板挂牌上市。海思科:创新药HSK47388片新适应症临床试验申请获得受理。新华联:6月25日起证券简称变更为“盈新发展”。北方华创:已取得芯源微控制权。
2025-06-24 18:01
【海思科:HSK47388片新适应症IND申请获受理】6月24日电,海思科(002653.SZ)公告称,公司近日收到国家药品监督管理局下发的《受理通知书》,HSK47388片拟用于自身免疫疾病的治疗的境内生产药品注册临床试验申请已获受理。该药物为公司自主研发的口服、强效、高选择性的化学药品1类,临床前研究显示其在大鼠肠炎模型中具有显著药效和良好的耐受性。此次申请为HSK47388片在自身免疫疾病领域的新适应症临床试验申请,有望为患者提供新的治疗选择。但需注意创新药研发周期长、环节多、风险高,投资者需谨慎决策。
2025-06-12 22:22
【6月12日46股收盘价创历史新高】6月12日电,据数据宝统计,不含近一年上市的次新股,今日共有46股收盘价创历史新高。按所属板块来看,主板有22只,创业板有11只,科创板有6只。从行业属性来看,医药生物、银行、基础化工行业创新高的个股较为集中,分别有11只、6只、5只个股出现在名单中。从股价表现来看,收盘价创历史新高股中,今日股价平均上涨4.92%,涨停的有柏星龙、海思科、若羽臣,涨幅居前的有同心传动、雷迪克、路桥信息等。
2025-06-12 14:46
【创新药概念震荡反弹,海思科、奥赛康双双涨停】创新药概念震荡反弹,海思科、奥赛康双双涨停,荣昌生物、舒泰神、睿智医药、益方生物-U等跟涨。
2025-06-12 13:20
【创新药概念再度拉升 百济神州涨超7%创历史新高】6月12日电,午后创新药概念再度拉升,百济神州涨超7%,再创历史新高,此前奥赛康涨停,荣昌生物、睿智医药、博瑞医药涨超10%,海思科、舒泰神、万邦德等多股涨超5%。消息面上,今日记者获悉,港股创新药企中国生物制药在第46届高盛全球医疗健康年会上透露,今年将至少有1个重量级的out-license交易落地。该股受此消息刺激大涨超15%,总市值突破1000亿港元。
2025-06-12 13:15
创新药概念午后拉升,奥赛康涨停,博瑞医药、睿智医药涨超10%,海思科、长春高新、微芯生物、舒泰神等涨幅居前
2025-06-09 17:13
【海思科:自主研发的创新药HSK47977片IND申请获受理】6月9日电,海思科(002653.SZ)公告称,公司近日收到国家药品监督管理局下发的《受理通知书》,HSK47977片是公司自主研发的全球新口服小分子抗肿瘤药物,拟用于淋巴瘤的治疗。目前全球同靶点药物暂无临床数据公布,国内也尚无同靶点药物进入临床阶段。
2025-05-21 11:59
【海思科:获得1类创新药安瑞克芬注射液《药品注册证书》】5月21日电,海思科公告,公司于5月21日收到国家药品监督管理局下发的1类创新药安瑞克芬注射液(商品名称:思舒静®,研发代号:HSK21542)《药品注册证书》,安瑞克芬注射液是公司自主研发的高选择性外周kappa阿片受体(κOpioid Receptor,KOR)激动剂,亦是全球首个获得镇痛适应症的无须纳入麻精药品管理的白处方阿片类镇痛药物,具有重大的临床意义和社会意义。
2025-05-14 05:07
【明晟公司MSCI新增30只股票到MSCI ACWI指数 并从中剔除61只股票】5月14日电,明晟公司(MSCI)公布了5月份指数审议结果。MSCI全球股票指数(ACWI)新纳入30只股票,剔除61只股票。其中MSCI中国指数新纳入芯原股份、百利天恒、惠泰医疗、光线传媒、海思科等6只股票;剔除海信家电、一汽解放、上海医药、金诚信等17只股票。此次调整将于5月30日收盘后生效。由于MSCI中国指数被嵌套进MSCI新兴市场指数,因此股票进入MSCI中国指数,便意味着进入了MSCI全球标准指数系列,从而获得被动资金跟踪。
2025-04-17 16:36
海思科:获得创新药HSK45030分散片IND申请《受理通知书》
2025-04-11 17:47
【海思科:2024年净利润3.95亿元 同比增长34%】4月11日电,海思科(002653.SZ)公告称,2024年营业收入37.21亿元,同比增长10.92%。归属于上市公司股东的净利润3.95亿元,同比增长34.00%。基本每股收益0.35元/股,同比增长29.63%。公司拟向全体股东每10股派发现金红利1.35元(含税),送红股0股(含税),不以公积金转增股本。
2025-04-11 14:17
【医药板块震荡走高 海思科、海南海药涨停】医药板块震荡走高,海思科快速涨停,海南海药此前涨停,常山药业、一品红、科兴制药、翰宇药业等涨幅居前。
2025-04-11 14:12
创新药概念震荡拉升,海思科午后涨停,股价创出历史新高,一品红涨超10%,科兴制药、阳光诺和、百奥泰、百济神州、翰宇药业等多股涨超5%
2025-03-12 18:18
海思科:获得创新药HSK44459片两项新适应症《药物临床试验批准通知书》
2025-02-27 19:40
海思科:拟定增募资不超过13.65亿元,用于新药研发项目、补充流动资金
2025-02-05 21:47
海思科:公司拟以自有资金在美国设立子公司 HEXGEN PHARMACEUTICAL HOLDING LIMITED,注册资本5万美元
2025-02-05 19:35
【海思科:HSK39004吸入粉雾剂临床试验获批】海思科公告,公司子公司西藏海思科制药有限公司和四川海思科制药有限公司近日收到国家药监局下发的《药物临床试验批准通知书》,经审查,2024年11月受理的HSK39004吸入粉雾剂符合药品注册的有关要求,同意开展临床试验。HSK39004是公司自主研发的全新的具有独立知识产权的靶向小分子抑制剂,临床拟用于慢性阻塞性肺疾病的治疗。
2025-01-22 16:00
【海思科:获得创新药HSK44459片新适应症《药物临床试验批准通知书》】1月22日电,海思科公告,公司于近日收到国家药品监督管理局下发的《药物临床试验批准通知书》,同意HSK44459片开展白塞病的临床试验。HSK44459片是公司自主研发的全新具有独立知识产权的治疗白塞病的药物,有望成为白塞病的有效治疗药物并解决目前临床用药匮乏的难题。此前,HSK44459已获得“间质性肺疾病”适应症的临床试验批准通知书,并已完成Ⅰ期临床研究。公司将根据该项目的后续进展及时履行信息披露义务。
2024-12-30 20:28
海思科:获得创新药HSK44459片两项新增适应症IND申请《受理通知书》
2024-12-01 17:32
海思科:公司及子公司西藏海泽于11月29日收到西藏山南市投资促进局拨付的产业扶持资金合计7,551.27万元,上述资金已到账。本次获得的产业扶持资金与公司日常经营活动相关,不具备可持续性
-
VIP复盘工具
- 更多复盘工具
- 股票复盘百科
-
股票复盘知识
- 新股民导航:稳健投资的十二条黄金法则
- 股市智慧:散户的炒股艺术与生存法则
- 把握市场脉搏:投资者如何避免错过好行情
- 揭秘股市先机:先于龙策略的深度剖析与实战应用
- 掌握“跌减涨增量”法则,精准捕捉股市买卖点
- 如何在重大技术位前精准判断与应对:策略与实践
- 炒股智慧:揭秘加仓策略与资金管理的艺术
- 超短线交易精髓:掌握复盘的艺术
- 盘中预知股价拉升:技术与策略的深度剖析
- 掌握这四个关键步骤,选股不再难
- 透视股市黑马:成交量变化中的主力动向与建仓策略
- 换股策略:解锁固定筹码的增值密码
- 揭秘庄股盘面异动的五种信号
- 长方矩形形态深度解析:掌握股市箱体理论的实战精髓
- 揭秘牛股追踪术:从暴跌中寻金,精准捕捉翻倍潜力
- 揭秘股市暗流:识别庄家操纵股票的实战策略
- 涨停板梯队与市场赚钱效应的深度剖析
- 精准捕捉短线卖点:理解并利用市场分歧
- 深度揭秘:主力操盘手在证券市场的多样手法与策略
- 高手秘籍:精准把握逃顶时机,七大法宝揭秘
当前版本:V3.0

 VIP复盘网
VIP复盘网
