
扫码报名
CAR-T疗法:CAR-T疗法是近年来发展迅速的肿瘤免疫治疗技术,在血液肿瘤治疗领域取得突破性进展,市场潜力巨大
- 板块介绍
- 板块资讯
- 强势股票
1、板块介绍
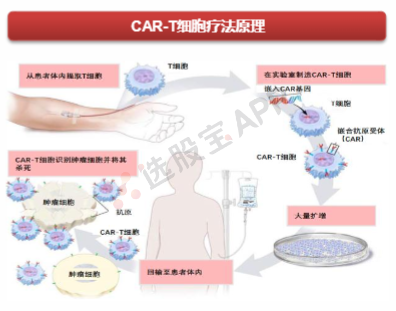
CAR-T疗法,全称为 Chimeric antigen receptor T cells,嵌合抗原受体T细胞免疫疗法,是指经过基因工程改造过的,可以表达特定T细胞受体,用于免疫治疗的一类T细胞。CAR-T中的嵌合抗体给予了改造后的T细胞识别特定蛋白的能力,嵌合一词的解释是因为其抗体既具有抗原识别功能也具有T细胞激活功能。
CAR-T细胞源既可以是CD4+也可以是CD8+,两种细胞类型的比例为1:1,可提供协同抗肿瘤作用。CAR-T细胞可以来源于患者自身血液中的T细胞(自体),也可以来源于另一个健康供体的T细胞(异体)。为安全起见,CAR-T细胞被设计为仅对肿瘤上表达的抗原具有特异性,而健康细胞上不表达。在注入患者体内后,CAR-T细胞与癌细胞上的目标抗原接触时,CAR-T细胞被激活,然后继续增殖并具有细胞毒性。 CAR-T细胞通过多种机制破坏细胞,包括其本身通过分泌穿孔素和颗粒酶,致使癌细胞裂解;同时通过分泌可影响其他细胞的因子(如细胞因子、白介素和生长),招募更多的免疫效应器发挥作用。CAR-T细胞可以从患者自己的血液中制造,称为自体治疗,也可以从健康供体的血液中制造,称为同种异体治疗。目前上市的稳定安全的疗法均为自体治疗,同种异体治疗是CAR-T研究的一个热门方向。
CAR-T细胞疗法全球研发管线迅速增长,细胞疗法主要集中于血液瘤治疗,实体瘤进展缓慢,在实体瘤中,因其异质性,找到仅在癌细胞上高度表达的抗原具有相当的难度,CAR-T细胞也不能有效地运输到实体瘤块的中心,而且肿瘤微环境会抑制T细胞活性。
研发趋势:
从血液瘤向实体瘤突破。血液瘤领域CAR-T项目靶点较为集中,CD19是CAR-T疗法中最成功的靶点,其次为BCMA。目前已批准上市的CAR-T项目中,有6个针对CD19靶点,2个针对BCMA靶点。而其他血液瘤靶点尚无申请上市或已批准上市项目;实体瘤领域CAR-T项目靶点较为分散,实体瘤类型繁多、致病机制多样,靶标选择难度大,缺乏独特的肿瘤相关抗原作为靶点,这也是目前实体瘤CAR-T疗法难以突破的原因之一。目前实体瘤靶点研究项目多处在I期临床。
血液瘤靶点:CAR-T血液瘤部分靶点较集中,以CD19、BCMA为主,靶向CD19CAR-T主要集中在白血病和淋巴瘤领域,靶向BCMACAR-T则主要集中在多发性骨髓瘤,其他新兴靶点也正在持续升温。目前已批准上市的产品靶点主要为CD19。
实体瘤靶点:总体较为分散,临床前项目主要靶点为MSLN、HER2和EGFR,临床项目靶点主要是MSLN、GPC3和EGFR,目前尚无申请上市及已批准上市产品,相关研究较血液瘤相对滞后。
未来发展:改进单靶点CAR-T,迈向以联合CAR-T、双靶点CAR-T、三靶点CAR-T为主的多靶点时代。商业化趋势:美国医保支付体系推动CAR-T疗法商业化进程,国内CAR-T药物降价仍具想象空间。美国当前CAR-T疗法报销政策下,CAR-T细胞治疗产品纳入DRG打包支付,创建新的MS-DRG,利用DRG付费“结余留用,超额自负”的作用机制,有效控制CAR-T产品治疗费用,减轻患者负担,同时降低Medicare支付压力。在国内,目前CAR-T药物纳入医保仍存在困难,CAR-T降价仍然具有想象空间。
2024-11-27 18:00
华东医药:全资子公司华东医药(杭州)有限公司独家商业化的靶向CD19的自体CAR-T候选产品,IM19嵌合抗原受体T细胞注射液的药品注册上市许可申请获国家药品监督管理局受理
2024-10-30 20:10
今年的4个CAR-T品种没有通过专家评审,未能进入国谈现场谈判环节
从权威渠道获悉,今年的4个CAR-T品种全部止步于形式审查,没有通过专家评审,没有进入国谈的现场谈判环节。业内普遍认为, 制约CAR-T药物进入医保的最大问题是高达百万的年治疗费用,高昂的费用已经超出了医保“保基本”的范围。 (第一财经)
2024-08-28 20:15
细胞治疗药品产业成“新赛道”,上海修订CAR-T管理规定
上海市药品监督管理局印发《上海市自体嵌合抗原受体T细胞(CAR-T)监督管理规定》。记者获悉,原有的暂行规定至2024年8月31日到期。新的规定“无缝衔接”,在成为正式规定的同时,也为上海市其他类型细胞治疗药品上市后的监督管理提供了参照。《CAR-T管理规定》有效期也从“2年”修改为“5年”,自2024年9月1日起施行,与原文件有效衔接。(澎湃)
2024-08-18 08:23
有望治疗多种自身免疫疾病的CAR-T疗法结果积极,驯鹿生物CAR-T疗法获新进展
近期,全球细胞和基因疗法(CGT)领域迎来系列进展。有望治疗多种自身免疫疾病的嵌合抗原受体(CAR)-T细胞疗法KYV-101的最新临床试验结果出炉,其中,1名重症肌无力患者在接受治疗后1年时临床疾病症状消失。肿瘤浸润淋巴细胞(TIL)疗法TIDAL-01治疗微卫星稳定(MSS)转移性结直肠癌(mCRC)患者的初步1期临床试验数据显示,疾病控制率(DCR)为50%,1名患者获得完全缓解(CR)。驯鹿生物CAR-T细胞疗法伊基奥仑赛注射液的IND申请获美国FDA批准,拟用于治疗非肾脏系统性红斑狼疮和系统性红斑狼疮性肾炎,这是该产品在自身免疫性疾病领域于中美两国获得的第五个临床批件。(药明康德微信公号)
2024-08-08 22:07
东北制药:鼎成肽源目前两款产品即将进入临床
东北制药披露投资者关系活动记录表 ,公司拟收购北京鼎成肽源生物技术有限公司70%的股权,以加速向生物制药转型。鼎成肽源于2014年成立,主要围绕实体肿瘤进行细胞治疗产品的开发以及临床转化。与一般细胞治疗的公司不同,鼎成肽源围绕靶点发现、序列发现、序列评价和功能增强,先建立核心技术平台再开发产品。目前两款产品即将进入临床,一个针对KRAS-G12D的TCR-T,已获CDE的临床试验默示许可。另一个针对脑胶质瘤的CAR-T,去年获得美国FDA孤儿药认定,规划中美两地IND申请。鼎成肽源在TCR-T和CAR-T方向上,围绕胃癌、肝癌、胰腺癌、结直肠癌等,开发了多款细胞治疗产品,随时可以进入IND申报阶段。除此之外,基于领先的 TCR 序列发现平台,储备了大量TCR序列库的储备,这些TCR序列库也是未来产品开发转化的源泉。
2024-08-05 20:36
东北制药:公司与张嵘签署《股权收购框架协议》,拟收购北京鼎成肽源生物技术有限公司70%的股权。本次收购目标公司的控股权,有利于优化公司业务结构,快速切入特异性细胞免疫治疗技术研究、产品开发和临床应用
2024-07-03 05:41
潜在“first-in-class"CAR-T疗法积极临床结果公布:超70%患者达主要终点
Cartesian Therapeutics今天宣布了其在研mRNA细胞疗法Descartes-08在全身性重症肌无力(MG)患者中的2b期临床试验的积极顶线结果。主要疗效终点评估了重症肌无力复合(MGC)评分减少5分或以上的患者比例。次要终点评估了安全性、耐受性和其他验证的MG严重程度量表,包括日常生活活动(MG-ADL)、定量重症肌无力(QMG)和MG生活质量修订量表(MG-QoL-15R)。Descartes-08是一种mRNA细胞疗法候选药物,也是一种潜在“first-in-class"mRNA工程化嵌合抗原受体T细胞(mRNA CAR-T)疗法。它通过靶向BCMA,清除分泌自身抗体的浆细胞。与传统的基于DNA的CAR-T细胞疗法相比,mRNA CAR-T细胞疗法的给药设计不需要预处理化疗,而且据观察具有可预测和可控制的药代动力学,可以进行门诊给药,并避免了基因整合和癌症转化的风险。(药明康德)
2024-07-03 05:39
延长癌症总生存期!强生/传奇生物CAR-T疗法3期积极结果公布
强生(Johnson & Johnson)与传奇生物(Legend Biotech)今天共同宣布了3期CARTITUDE-4研究预定第二次中期分析的积极结果,该研究评估了两者联合开发的嵌合抗原受体(CAR)T疗法Carvykti(ciltacabtagene autoleucel,cilta-cel)与标准疗法相比,用于治疗复发性或经过1线治疗对来那度胺(lenalidomide)耐药的多发性骨髓瘤(MM)患者。中期分析显示,与标准疗法相比,接受Carvykti治疗患者的总生存期(OS)有统计学和临床意义上的改善。详细数据将公布于即将来临的医学会议当中,并递交给全球监管单位。根据新闻稿,Carvykti是获批用于多发性骨髓瘤患者二线或以上治疗的首个B细胞成熟抗原(BCMA)靶向CAR-T疗法。(药明康德)
2024-06-11 19:59
首单CAR–T商业化产品出境正推进,浦东综改助推行业出海
一项名为“CAR–T细胞治疗商业化产品出境管理”的制度创新,正在为浦东新区乃至上海和全国的CAR–T细胞治疗行业拓展海外市场,带来可观的想象空间。与其他药品的出境不同的是,CAR–T细胞治疗需要先获得境外患者的免疫细胞,在36~44小时内送到工厂,制备完成后再将产品运送至境外的医疗机构。也因此,如何实现有特殊时效、特定运输条件、进出境的双向管理的创新模式,给企业和监管都带来了新的课题和挑战。(一财)
2024-05-09 23:03
华邦健康:公司参股企业涉及细胞治疗及干细胞相关业务
华邦健康5月9日在互动平台表示,公司参股企业涉及细胞治疗及干细胞相关业务。1、河北生命原点生物科技有限公司是河北省干细胞库的建设和运营方,其核心业务为新生儿干细胞、成人免疫细胞等细胞存储业务和干细胞产品临床研究和应用转化。2、深圳普瑞金生物药业股份有限公司主要从事细胞与基因治疗创新药物研发,其产品管线包括CAR-T及CAR-NK等,适应症涵盖血液系统肿瘤、实体瘤、自身免疫性疾病等领域。3、江苏谱新生物医药有限公司主要从事细胞与基因治疗药物CDMO业务,搭建了细胞药物专用质粒构建平台、悬浮无血清病毒生产平台和全封闭的细胞工艺开发平台,已支持多个合作伙伴成功孵化了多款CAR-T、TCR-T、干细胞等药物。
2024-03-16 00:51
强生和百时美施贵宝的CAR-T癌症疗法获得美国FDA专家组支持
3月15日美股盘后,美国食品药品管理局(FDA)顾问组投票,以11-0票倾向于扩大强生公司Carvykti的(适用)标签。他们(一致)认为,Carvykti(CAR-T疗法)在用于治疗骨髓瘤(myeloma)方面利大于弊。3月14日美股盘后(亚太早盘),百时美施贵宝宣布,美国FDA加速批准其Breyanzi疗法,该疗法针对成年人复发、或难治性慢性淋巴细胞白血病、或小淋巴细胞淋巴瘤。
2024-03-05 20:55
国内第五款CAR-T疗法首发价格115万
国内获批的第五款CAR-T疗法,科济药业旗下的泽沃基奥仑赛注射液(商品名:赛恺泽),首发价格为115万元,预计该药的年终端销售额的峰值可达10亿元以上。(澎湃)
2024-01-12 18:48
新开源:与华道(上海)生物医药有限公司签署战略合作协议,华道生物指导上海新开源按照细胞药物GMP生产要求建设一个CAR-T细胞药物研发孵化器,为CAR-T细胞药物研发企业或科学家提供细胞药物转化服务;华道生物同意在独家销售权授权费用同等条件下优先委托上海新开源负责HD CD19 CAR-T药物在山西、河南、湖北、湖南四省的市场独家销售权
2023-12-13 11:49
FDA要求子公司暂停三款CAR-T的临床试验,科济药业回应:并未针对公司临床数据提出疑问
12月12日,科济药业公告称,科济药业在美国的子公司收到FDA通知,要求暂停CT053、CT041和CT071的临床试验,等待位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。上述三款在研产品均为CAR-T疗法。受上述消息影响,科济药业13日股价异动,截至发稿跌幅超26%。12月13日,科济药业向记者表示,FDA本次并未针对公司临床数据提出疑问,此次FDA的专业建议主要是因CMC(化学、制造和控制)相关问题,有些员工培训等遗留问题需进行合规完善,并非针对工艺问题,这也让公司有了明确的观察项,帮助公司更有针对性地提升。(澎湃)
2023-12-12 22:27
科济药业:因CMC相关问题在美国暂停临床试验
科济药业控股有限公司港交所公告,本公司在美国的子公司CARsgenTherapeuticsCorporation于北京时间12月11日晚上收到美国食品药品监督管理局(FDA)的通知,要求暂停CT053、CT041和CT071的临床试验,等待对位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。本公司将对现行药品生产质量管理规范(cGMP)进行全面检查和改进,并承诺与FDA密切合作,解决检查发现的问题,以确保临床试验和上市申请的顺利进行和高质量生产。
| ID | 股票名称 | 涨幅% | 现价 | 换手率% | 总市值 | 炒作逻辑 |
|---|

 VIP复盘网
VIP复盘网
