|
华纳药厂
688799 |
0.46%
|
最新:41.34
开盘:41.1 昨收:41.15 |
开盘%:-0.12%
振幅%:1.7% 换手%:1.06% |
最高:41.44
最低:40.74 量比:0.95 |
总市值:39 亿
流通值:39 亿 成交额:1 亿 |
- 基本信息
- 个股快讯
- 上市公司
- 龙虎榜
- 历史涨停原因
- 董秘互动
- 分时图
- 日K图
- 周K图
- 月K图
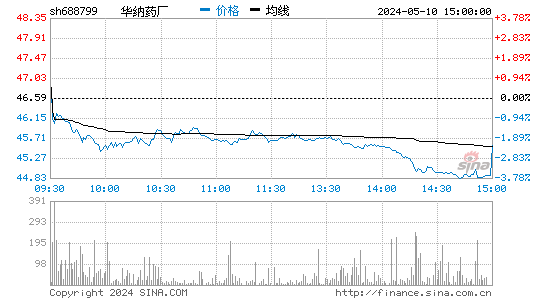
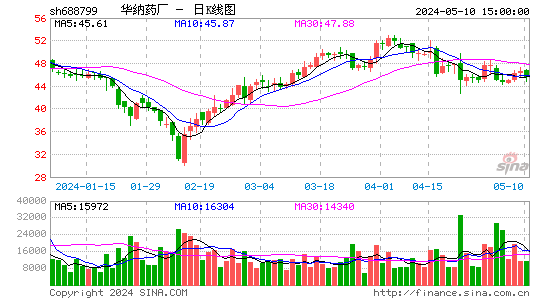
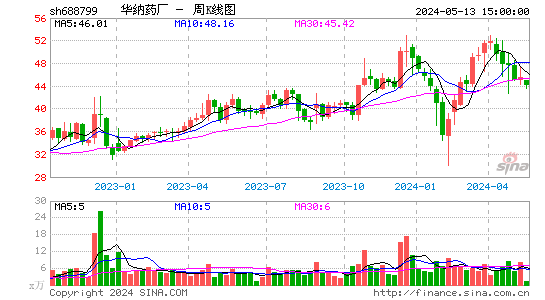
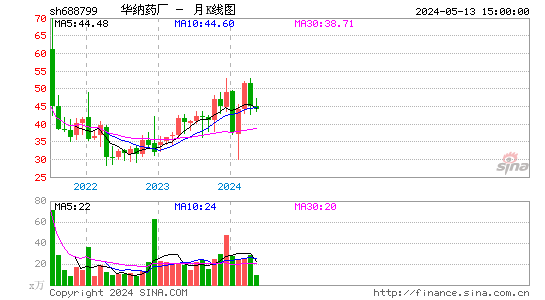
2024-09-30 18:26
【华纳药厂:子公司ZG-001胶囊完成Ⅰ期临床试验并签署合作框架协议】华纳药厂公告,控股子公司致根医药在研项目ZG-001胶囊在国家药品监督管理局同意下开展I期临床试验已于近期完成,致根医药与首都医科大学附属北京安定医院就ZG-001项目在中国大陆联合开发签订该项目《合作框架协议》。ZG-001拟用于治疗成人抑郁障碍,包括伴有自杀意念或行为的重性抑郁障碍(MDSI)或难治性抑郁(TRD)或重性抑郁障碍(MDD)。
2024-08-22 21:08
【华纳药厂:ZG-002片获药物临床试验批准通知书】华纳药厂(688799)8月22日晚间公告,近日,公司控股子公司致根医药收到国家药品监督管理局核准签发的关于ZG-002片的《药物临床试验批准通知书》。ZG-002是致根医药自主开发的具有全新结构的新型抗自身免疫性疾病的药物,属于1类新药。ZG-002目前拟用于治疗中重度斑块状银屑病。
2024-08-22 16:18
【华纳药厂:子公司ZG-002片获得药物临床试验批准通知书】8月22日电,华纳药厂公告,公司控股子公司致根医药收到国家药品监督管理局核准签发的关于ZG-002片的《药物临床试验批准通知书》。ZG-002是致根医药自主开发的新型抗自身免疫性疾病的1类新药,目前拟用于治疗中重度斑块状银屑病。根据相关法律法规要求,药物在获得临床试验批准后,需开展临床试验并经国家药监局审评、审批通过后方可生产上市。新药研发存在不确定性,投资者请谨慎决策。
2024-08-09 20:24
【华纳药厂:子公司二甲硅油原料药上市申请获批】华纳药厂(688799)8月9日晚间公告,全资子公司湖南华纳大药厂手性药物有限公司收到国家药监局签发的二甲硅油《化学原料药上市申请批准通知书》。二甲硅油是一种消泡沫药,用于因胃肠道内的气体而引起的腹部症状的改善;进行胃内窥镜检查时,除去胃内有泡性粘液;进行X光检查腹部时,驱除肠内的气体。
2024-05-29 16:40
【华纳药厂:子公司原料药精氨酸布洛芬获上市申请批准通知书】5月29日电,华纳药厂公告,近日公司全资子公司湖南华纳大药厂手性药物有限公司收到国家药品监督管理局签发的精氨酸布洛芬《化学原料药上市申请批准通知书》,并在国家药品监督管理局药品审评中心(CDE)“原料药、药用辅料和药包材登记信息公示”平台公示。精氨酸布洛芬属于消炎镇痛药,主要适用于牙痛、痛经等症状。精氨酸布洛芬能抑制前列腺素的合成,具有镇痛、解热和抗炎的作用。
2024-05-29 16:14
华纳药厂:子公司原料药精氨酸布洛芬获得上市申请批准通知书
2024-05-27 17:06
【华纳药厂:子公司原料药盐酸贝尼地平获得上市申请批准通知书】5月27日电,华纳药厂公告,全资子公司湖南华纳大药厂手性药物有限公司收到国家药品监督管理局签发的盐酸贝尼地平《化学原料药上市申请批准通知书》。盐酸贝尼地平属于钙通道类阻滞药,主要用于治疗原发性高血压,心绞痛。
2024-05-27 17:04
华纳药厂:子公司原料药盐酸贝尼地平获得上市申请批准通知书。
2024-05-23 17:33
华纳药厂:拟以自有资金认缴出资不超过人民币4000万元,认缴禾怡远景17.9767%的出资额
2024-05-14 16:41
华纳药厂:子公司原料药碳酸镧获得上市申请批准通知书
2024-05-10 16:14
华纳药厂:药品米力农注射液通过仿制药质量和疗效一致性评价。
2024-05-10 16:03
【华纳药厂表示 药品米力农注射液已通过仿制药质量和疗效一致性评价】华纳药厂表示,药品米力农注射液已通过仿制药质量和疗效一致性评价。
2024-03-22 15:55
华纳药厂:获得吸入用复方异丙托溴铵溶液药品注册证书。
2024-01-29 16:07
【华纳药厂:收到复方聚乙二醇电解质散(Ⅲ)《药品注册证书》】1月29日电,华纳药厂公告,收到国家药品监督管理局核准签发的复方聚乙二醇电解质散(Ⅲ)《药品注册证书》,复方聚乙二醇电解质散(Ⅲ)用于以下情况之前的患者结肠清洁准备:内窥镜或放射检查;结肠手术。
2024-01-11 15:51
【华纳药厂:ZY022项目已经完成临床前研究】华纳药厂近期披露投资者关系活动记录表显示,公司参股公司湖南省天玑珍稀中药材发展有限公司与中国医学科学院药物研究所联合开展珍稀濒危动物药材人工替代品研究项目,签署了多个珍稀濒危动物药材人工替代品研究项目的合作研发协议。公司利用自身已具备的生物发酵、化学合成、中药提取、单体成分分离纯化等成熟的生产配套体系,受托完成这两个项目的中试、生产验证及后续部分相关研究等工作。目前ZY022项目已经完成临床前研究,并按计划推进下一步研发工作。
2024-01-02 16:24
华纳药厂:药品奥硝唑注射液通过仿制药质量和疗效一致性评价
2023-12-20 16:06
【华纳药厂:双氯芬酸钠缓释片通过仿制药质量和疗效一致性评价】《科创板日报》20日讯,华纳药厂公告,药品双氯芬酸钠缓释片通过仿制药质量和疗效一致性评价。
2023-12-20 16:02
华纳药厂:药品双氯芬酸钠缓释片通过仿制药质量和疗效一致性评价
2023-11-21 15:53
【华纳药厂:ZG-001胶囊获得药物临床试验批准通知书】《科创板日报》21日讯,华纳药厂公告,公司、公司控股子公司致根医药、公司全资子公司手性药物公司收到国家药监局核准签发的关于ZG-001胶囊的《药物临床试验批准通知书》,同意其开展成人伴有自杀意念或行为的重性抑郁障碍(MDSI)的临床试验。
2023-11-21 15:50
华纳药厂:ZG-001胶囊获得药物临床试验批准通知书
2023-11-17 16:23
【华纳药厂:ZY022项目已经完成临床前研究】华纳药厂近期接受投资者调研时称,公司参股公司湖南省天玑珍稀中药材发展有限公司与中国医学科学院药物研究所联合开展珍稀濒危动物药材人工替代品研究项目,签署了保密编号为ZY022和ZY023的两个珍稀濒危动物药材人工替代品研究项目的合作研发协议。公司利用自身已具备的生物发酵、化学合成、中药提取、单体成分分离纯化等成熟的生产配套体系,受托完成这两个项目的中试、生产验证及后续部分相关研究等工作。目前ZY022项目已经完成临床前研究,并按计划推进下一步研发工作。
2023-11-07 16:05
华纳药厂:公司盐酸左沙丁胺醇雾化吸入溶液拟中标全国药品集中采购。
2023-11-03 18:07
华纳药厂:子公司原料药双氯芬酸钠获得上市申请批准通知书
2023-11-01 16:30
【华纳药厂:药品硝苯地平缓释片过仿制药质量和疗效一致性评价】《科创板日报》1日讯,华纳药厂公告,药品硝苯地平缓释片过仿制药质量和疗效一致性评价。

 VIP复盘网
VIP复盘网