
扫码关注公众号

扫码VIP小程序
系统提示:股票复盘网只提供基本的股票信息,如果需要了解实时、详细的股票行情数据,请登录VIP复盘网..
|
三生国健
688336 |
15.31%
|
最新:58.9
开盘:49.81 昨收:51.08 |
开盘%:-2.49%
振幅%:22.51% 换手%:3.46% |
最高:61.3
最低:49.8 量比:1.55 |
总市值:363 亿
流通值:363 亿 成交额:6 亿 |
- 基本信息
- 股票百科
- 个股快讯
- 上市公司
- 更多股票
- 专家分析
- 龙虎榜
- 历史涨停原因
- 董秘互动
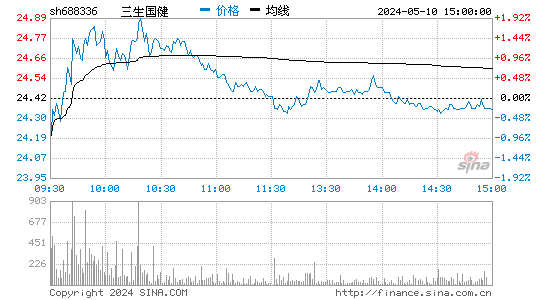
- 分时图
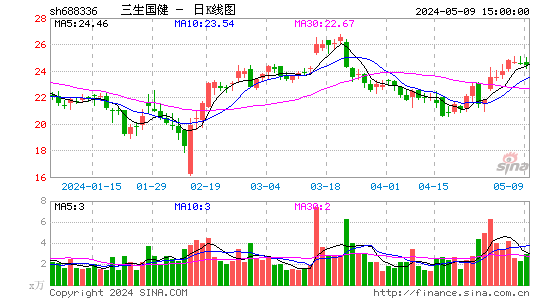
- 日K图
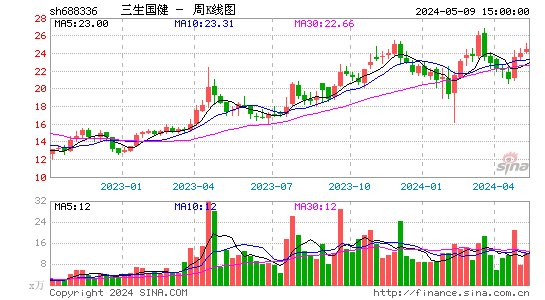
- 周K图
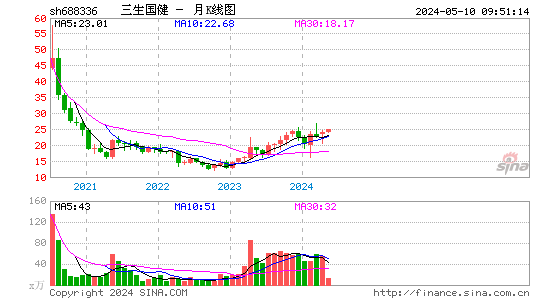
- 月K图
三生国健股票概况
深入解析三生国健的投资价值与行业地位
公司概况
三生国健自成立以来,始终致力于抗体药物的研发与创新,已在多个治疗领域取得了显著成果。公司产品线丰富,涵盖了肿瘤、自身免疫性疾病等多个治疗领域,为广大患者提供了新的治疗选择。
研发实力
创新药物研发:三生国健拥有一支高素质的研发团队,具备强大的创新能力。公司不断投入研发资源,推动新药的研发进程,力求在抗体药物领域取得更多突破。
技术平台:公司建立了完善的抗体药物研发技术平台,包括抗体筛选、优化、生产等多个环节,为药物的研发提供了有力支持。
市场表现
三生国健股票在资本市场上表现稳健,受到众多投资者的青睐。随着公司业务的不断拓展和产品线的持续丰富,其股票的投资价值将进一步凸显。
投资价值
从行业前景来看,生物医药行业具有广阔的发展空间。三生国健作为抗体药物领域的佼佼者,具备显著的竞争优势和投资价值。
# 行业地位
三生国健在抗体药物领域拥有较高的知名度和影响力。公司凭借强大的研发实力和丰富的产品线,已成为国内抗体药物市场的领军企业之一。
# 竞争优势
公司在研发、生产、销售等多个环节均具备明显的竞争优势。在研发方面,公司拥有先进的抗体药物研发平台和丰富的研发经验;在生产方面,公司具备高效的生产能力和严格的质量控制体系;在销售方面,公司拥有完善的销售网络和专业的销售团队。
# 发展前景
未来,随着生物医药行业的持续发展和抗体药物市场的不断扩大,三生国健将迎来更加广阔的发展前景。公司将继续加大研发投入,拓展产品线,提升核心竞争力,为投资者创造更多价值。
总结
三生国健作为抗体药物领域的领军企业,具备显著的研发实力和市场竞争力。其股票在资本市场上表现稳健,具有较高的投资价值。未来,随着公司的不断发展,其投资价值将进一步得到释放。
{summary}
三生国健是一家专注于创新抗体药物研发的生物医药企业,拥有强大的研发实力和丰富的产品线。公司在抗体药物领域具有较高的知名度和影响力,其股票在资本市场上备受关注。未来,三生国健将迎来更加广阔的发展前景。{/summary}
2025-05-22 19:14
【4连板三生国健:与辉瑞就707项目达成合作 许可方实际收取的销售里程碑款项和特许权使用费存在不确定性】22日讯,三生国健(688336.SH)公告称,公司股票交易连续两个交易日内收盘价格涨幅偏离值累计超过30%,连续四个交易日内日收盘价格涨幅偏离值累计超过100%,属于股票交易异常波动情形。公司及本公司的关联方三生制药和沈阳三生制药有限责任公司(简称“沈阳三生”,以下合称“许可方”)共同授予被许可方辉瑞公司(Pfizer Inc.)(简称“被许可方”)在许可区域(即除中国大陆以外的其他国家和地区)及领域(即人类和兽医用途的所有治疗、诊断及预防适应症)的独家开发、生产和商业化许可产品707项目(即同时靶向PD-1和VEGF的双特异性抗体产品)的权利。于本次交易中所约定的销售里程碑款项和特许权使用费的支付,须以约定的销售达成情况作为触发条件。许可产品上市后的销售情况可能受到(包括但不限于)用药需求、市场竞争、销售渠道等因素影响,存在不确定性。因此,许可方实际收取的销售里程碑款项和特许权使用费亦存在不确定性。
2025-05-20 18:16
【2连板三生国健:公司与辉瑞公司合作的707项目实施过程亦存在不确定性】5月20日电,三生国健(688336.SH)发布股票交易异常波动公告,公司与辉瑞公司合作的707项目,即同时靶向PD-1和VEGF的双特异性抗体产品,尚需履行必要的内部决策程序,并需经有权监管机构批准后方可正式实施,实施过程亦存在不确定性。
2025-02-19 18:03
三生国健:与沈阳三生制药有限责任公司签署许可协议,拟将公司612项目和708项目独家授予给沈阳三生,许可区域为中国大陆地区。本次交易对价包括首付款1.02亿元,里程碑付款及后续权利金
2025-01-16 18:16
【三生国健:2024年净利同比预增137.73%到162%】三生国健发布业绩预告,2024年度预计实现归属于母公司所有者的净利润7亿元到7.72亿元,同比增加137.73%到162.00%。报告期内,公司主要产品收入持续实现稳健增长;同时公司收到参股公司Numab Therapeutics, AG特别股息分配6242.47万美元(折合人民币约为4.47亿元),分红款计入本期损益,对公司2024年度经营业绩产生积极影响。
2025-01-09 19:27
【三生国健:SSGJ-627注射液临床试验申请获受理】三生国健公告,公司收到国家药监局核准签发的《受理通知书》,SSGJ-627注射液的临床试验申请获得受理。SSGJ-627注射液是公司创新研发,拥有自主知识产权的重组抗TL1A人源化单克隆抗体。
2025-01-09 16:56
三生国健:公司SSGJ-627注射液获得药物临床试验申请受理通知书
2024-09-03 16:30
【三生国健:收到参股公司分红款6242.47万美元】三生国健公告,公司持有参股公司Numab Therapeutics, AG 7.87%的股份。根据Numab一项与其子公司有关的特别股东决议,Numab向其股东进行了特别股息分配,公司收到6,242.47万美元。根据相关会计准则,上述分红款计入公司2024年度损益,对公司2024年度经营业绩产生积极影响。
2024-08-22 20:42
【三生国健:上半年净利润同比增长36.68% 拟10派0.33元】三生国健披露半年报,2024年上半年实现营业收入5.97亿元,同比增长24.87%;净利润1.3亿元,同比增长36.68%。公司拟向全体股东每10股派发现金红利0.33元(含税)。
2024-08-22 20:29
【三生国健:上半年净利润同比增长36.68% 拟10派0.33元】三生国健(688336)昨晚披露半年报,公布2024年上半年的经营成果。报告显示,半年营业收入达到5.97亿元,较去年同期增长24.87%;净利润则达到1.3亿元,同比增长36.68%。此外,公司还拟向所有股东派发现金红利,每10股派发0.33元(含税)。
2024-08-09 15:42
【三生国健:公司重组抗IL-17A人源化单克隆抗体注射液(SSGJ-608)治疗中重度斑块状银屑病III期临床试验达到所有疗效终点】8月9日电,三生国健公告,公司重组抗IL-17A人源化单克隆抗体注射液治疗成人中重度斑块状银屑病的关键注册性Ⅲ期临床试验《一项评价重组抗IL-17A人源化单克隆抗体注射液治疗中国中重度斑块状银屑病受试者的有效性和安全性的多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验》已完成揭盲及最终统计分析,所有主要疗效终点(PASI75和sPGA0/1)、关键次要疗效终点(PASI90、PASI100和sPGA0)和所有次要疗效终点均成功达到。
2024-06-05 18:50
【三生国健:与沈阳三生制药签署排他性许可协议】《科创板日报》5日讯,三生国健公告,为提升资金使用效率,降低临床开发风险,公司拟与沈阳三生制药有限责任公司(简称“沈阳三生制药”)签署《排他性许可协议》,将公司706、709、HBT-2002、QY-F10、QY-F11、QY-F07、QY-F02项目独家授予沈阳三生,许可区域为大中华地区。此次交易对价包括首付款23614万元,里程碑付款及后续权利金。沈阳三生制药与公司受同一实控人LOU JING控制,且直接持有公司6.42%的股份。
2024-06-05 18:47
三生国健:拟与沈阳三生签署《排他性许可协议》,拟将公司706、709、HBT-2002、QY-F10、QY-F11、QY-F07、QY-F02项目独家授予给沈阳三生,许可区域为大中华地区。本次交易对价包括首付款2.36亿元,里程碑付款及后续权利金
2024-01-24 17:17
【三生国健:公司抗IL-4Rα人源化单克隆抗体III期临床试验完成首例患者入组】《科创板日报》24日讯,三生国健公告,公司抗IL-4Rα人源化单克隆抗体III期临床试验完成首例患者入组。
2023-12-13 19:54
【三生国健:获得《药物临床试验批准通知书》】三生国健公告,公司重组抗IL-4Rα人源化单克隆抗体注射液收到国家药监局核准签发的儿童及青少年(6周岁≤年龄<18周岁)中重度特应性皮炎临床试验《药物临床试验批准通知书》,目前SSGJ-611在中国成人中重度特应性皮炎临床试验已进入III期,慢性鼻窦炎伴鼻息肉适应症的II期临床试验已经完成首例患者入组,慢性阻塞性肺疾病(COPD)适应症的II期临床试验正在进行中。
-
VIP复盘工具
- 更多复盘工具
- 股票复盘百科
-
股票复盘知识
- DIFF与DEA:揭示行情走势的重要指标
- 天才投资者的智慧:掌握市场规律,静待大波动
- 弱市中的智慧之光:投资者自救的五大实战策略
- 金字塔建仓策略:稳健投资的智慧之选
- 炒股启程:科学学习,稳健前行
- 透视股市迷雾:揭秘上市公司吸引股民的十大策略与投资者应对之道
- 稳健波段操作:把握市场韵律,实现理性投资
- 揭秘股市炸板现象:深度解析与应对策略
- 散户攻略:精准捕捉飙升个股的七大策略
- 短线炒手速成指南:掌握核心策略,洞察市场脉动
- 炒股智慧:掌握六大小技巧,稳健盈利不是梦
- 危机中的机遇:如何慧眼识珠,把握优质股
- 牛市中化工与机械股的上涨逻辑深度剖析
- 洞悉股市脉动:以成交量捕捉翻倍牛股的策略
- 股市高手的投资心法:舍弃与等待的艺术
- 挖坑理论深度解析:精准捕捉股票买点的艺术
- 短线狙击秘籍:精准把握集合竞价,擒获牛股先机
- 揭秘股改除权价的速算艺术与投资策略
- 散户必备技巧:拉升中的逃离策略
- 顶级操盘手的入场时机与策略秘籍
当前版本:V3.0

 VIP复盘网
VIP复盘网
