|
微芯生物
688321 |
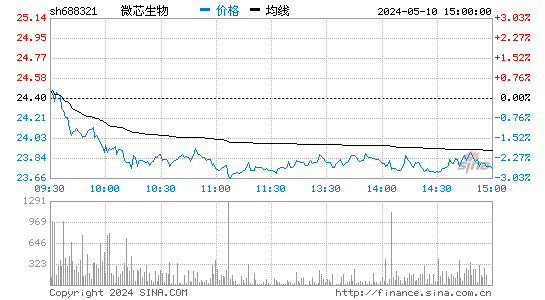
-9.28%
|
最新:21.02
开盘:23.02 昨收:23.17 |
开盘%:-0.65%
振幅%:9.54% 换手%:2.73% |
最高:23.16
最低:20.95 量比:2.07 |
总市值:86 亿
流通值:86 亿 成交额:4 亿 |
- 基本信息
- 个股快讯
- 上市公司
- 龙虎榜
- 历史涨停原因
- 董秘互动
- 分时图
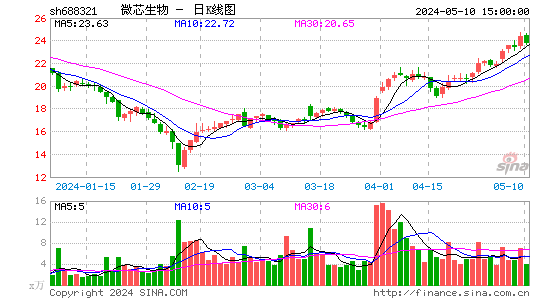
- 日K图
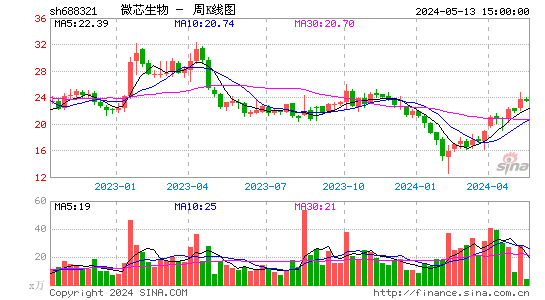
- 周K图
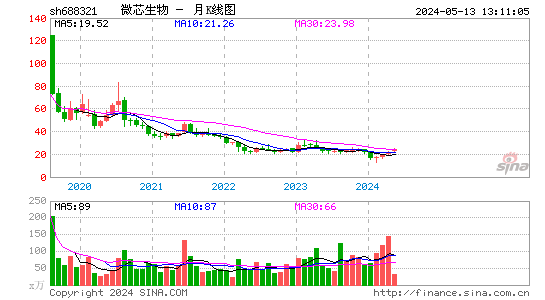
- 月K图
2024-11-20 19:20
微芯生物:拟定增募资不超9.6亿元,用于创新药研发项目及补充流动资金。
2024-11-20 19:08
【微芯生物:拟定增募资不超过9.6亿元】微芯生物公告,公司拟向特定对象发行股票拟募集资金总额不超过9.6亿元,募集资金总额扣除相关发行费用后的净额将用于投资创新药研发项目和补充流动资金。
2024-09-09 16:50
【微芯生物:入选国家级“第六批专精特新‘小巨人’企业名单”】微芯生物公告,近日,根据深圳市中小企业服务局正式发布的《深圳市第六批专精特新“小巨人”企业和第三批专精特新“小巨人”复核通过企业名单的公示》,公司入选国家级“第六批专精特新‘小巨人’企业公示名单”,入选名单的公示期已结束。
2024-08-27 23:05
【微芯生物:西奥罗尼胶囊治疗肺癌临床试验申请获受理】微芯生物8月27日晚间公告,公司及全资子公司成都微芯药业近日收到国家药监局签发的境内生产药品注册临床试验的受理通知书,西奥罗尼胶囊治疗广泛期小细胞肺癌临床试验申请获得受理。
2024-08-27 17:40
【微芯生物:西奥罗尼胶囊治疗广泛期小细胞肺癌临床试验申请获得受理】8月27日电,微芯生物公告,公司及全资子公司成都微芯药业有限公司近日收到国家药监局签发的境内生产药品注册临床试验的《受理通知书》,西奥罗尼胶囊治疗广泛期小细胞肺癌临床试验申请获得受理。本次申请为新药临床试验申请,在临床试验申请获得受理后,自受理之日起60日内未收到药审中心的否定或质疑意见的,公司便可以按照提交的方案开展临床试验。
2024-08-15 16:55
【微芯生物:上半年净利亏损4100.64万元 同比转亏】微芯生物(688321)8月15日晚间公告,上半年营业收入3.02亿元,同比增长25.06%;归母净利润亏损4100.64万元,上年同期为盈利1.56亿元。本期净利润下降主要系上年同期末微芯新域不再纳入公司合并报表范围,公司不再控制新域后的剩余股份按公允价值计算确认投资收益所致。
2024-07-19 16:53
【微芯生物:西格列他钠联合二甲双胍治疗2型糖尿病适应症获批】微芯生物(688321)于7月19日晚间公告,全资子公司成都微芯 近日获得国家药监局核准签发的《药品注册证书》,批准了该公司申报的西格列他钠片增加适应症。新增适应症为:在成人2型糖尿病患者中,single独使用盐酸二甲双胍无法控制血糖时,本品可与盐酸二甲双胍联合使用,配合饮食和运动,提高血糖控制效果。
2024-06-18 09:39
【微芯生物成立药业公司 含药品零售业务】企查查APP显示,近日,彭州微芯药业有限公司成立,法定代表人为海鸥,注册资本1000万元,经营范围包含:药品生产;药品零售;医学研究和试验发展等。企查查股权穿透显示,该公司由微芯生物全资持股。
2024-06-17 17:59
【微芯生物:西奥罗尼胶囊治疗胰腺癌获得药物临床试验批准】微芯生物公告,公司及全资子公司成都微芯药业有限公司近日收到国家药监局签发的境内生产药品注册临床试验的《药物临床试验批准通知书》,西奥罗尼联合白蛋白紫杉醇和吉西他滨一线治疗晚期胰腺癌的II期临床试验申请获得批准。
2024-06-02 16:37
微芯生物:公司药物西达本胺片拟纳入突破性治疗品种公示
2024-05-12 16:34
【微芯生物:西达本胺治疗结直肠癌III期临床试验申请获得受理】《科创板日报》12日讯,微芯生物公告,近日收到国家药监局药审中心签发的境内生产药品注册临床试验的《受理通知书》,西达本胺联合信迪利单抗和贝伐珠单抗治疗≥2 线标准治疗失败的晚期微卫星稳定或错配修复完整(MSS/pMMR)型结直肠癌的随机、开放性、对照、多中心、Ⅲ期临床试验获得国家药监局药审中心受理。西达本胺在中国已获批外周T细胞淋巴瘤、乳腺癌、弥漫大B细胞淋巴瘤三个适应症、在日本已获批成人白血病和外周T细胞淋巴瘤两个适应症、在中国台湾已获批乳腺癌适应症。
2024-04-30 15:45
【微芯生物:西达本胺联合R-CHOP治疗弥漫大B细胞淋巴瘤适应症获批上市】《科创板日报》30日讯,微芯生物公告,西达本胺联合R-CHOP治疗弥漫大B细胞淋巴瘤适应症获批上市。联合R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松)用于MYC和BCL2表达阳性的既往未经治疗的弥漫大B细胞淋巴瘤(DLBCL)患者。
2024-04-30 15:41
微芯生物:西达本胺联合R-CHOP治疗弥漫大B细胞淋巴瘤适应症获批上市。
2024-04-09 16:25
微芯生物:西奥罗尼胶囊治疗胰腺癌临床试验申请获得受理。
2024-04-08 17:13
【微芯生物:预计2个月内和CDE沟通西格列他钠NASH适应症III期临床方案】微芯生物4月8日在互动平台表示,基于现有临床研究数据,公司非常有意愿投入西格列他钠NASH适应症全球多中心的III期临床。公司目前正在着手设计III期临床,但考虑不同地区饮食等对NASH患者的影响,公司需要开展更多研究以支持临床方案的设计。公司预计2个月内和CDE沟通III期临床的方案,争取在2024年内启动中国部分的III期临床。
2024-04-03 16:12
【微芯生物:预计西格列他钠今年将保持高速增长】4月3日,在微芯生物业绩说明会上,创始人鲁先平表示,2024年是西格列他钠进入医保第二年,也是放量的关键期。2023年西格列他钠销量高增7倍以上,公司二号生产线已经投产,预计2024年仍将保持高速增长。(证券时报)
2024-03-18 20:26
【西格列他钠单药治疗非酒精性脂肪性肝炎的II期临床试验达成首要疗效终点】3月18日,微芯生物宣布,西格列他钠单药治疗非酒精性脂肪性肝炎(NASH)的II期临床试验(CGZ203研究)于2024年2月22日顺利完成了数据清理并锁库,试验首要疗效终点达成,进一步的数据分析工作正在进行中。
2024-01-31 18:36
微芯生物:董事长提议以800万元-1500万元回购股份
2023-12-13 15:42
微芯生物:公司产品西达本胺片续约进入国家医保目录。
2023-11-22 15:55
微芯生物:西格列他钠新增生产线获GMP认证通过。
2023-10-31 17:27
【微芯生物:CS32582胶囊获药物临床试验批准通知书】《科创板日报》31日讯,微芯生物公告,全资子公司成都微芯药业近日收到国家药监局签发的药物临床试验批准通知书,CS32582胶囊拟用于治疗银屑病的I期临床试验申请获得批准。
2023-10-31 17:17
微芯生物:CS32582胶囊获得药物临床试验批准通知书
2023-08-16 17:22
微芯生物:CS32582胶囊临床试验申请获得受理
2023-08-11 18:58
【微芯生物:上半年净利润1.56亿元 同比转盈】8月11日电,微芯生物公告,上半年净利润1.56亿元,上年同期净亏损1929万元。
2023-07-27 18:00
【微芯生物:双洛平目前已准备启用商业批的大产线】微芯生物在互动平台表示,双洛平目前已准备启用商业批的大产线,明年会增产。

 VIP复盘网
VIP复盘网