|
亚虹医药
688176 |
-5.43%
|
最新:7.32
开盘:7.66 昨收:7.74 |
开盘%:-1.03%
振幅%:5.43% 换手%:1.86% |
最高:7.73
最低:7.31 量比:0.81 |
总市值:42 亿
流通值:27 亿 成交额:4 亿 |
- 基本信息
- 个股快讯
- 上市公司
- 龙虎榜
- 历史涨停原因
- 董秘互动
- 分时图
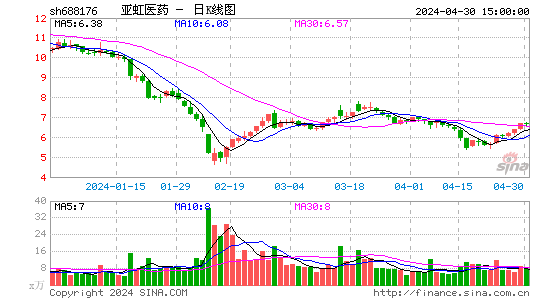
- 日K图
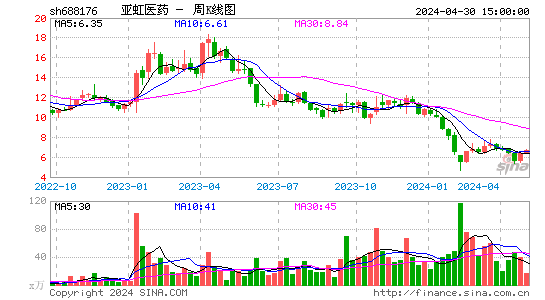
- 周K图
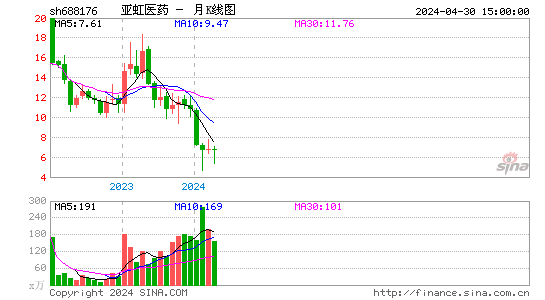
- 月K图
2024-11-12 17:00
【亚虹医药:APL-1702临床试验结果入选2024年IPVC】亚虹医药公告,近日,公司产品APL-1702用于治疗宫颈高级别鳞状上皮内病变的前瞻、随机、双盲、安慰剂对照的国际多中心Ⅲ期临床试验结果入选2024年国际乳头瘤病毒大会(IPVC),并以壁报形式发布本研究关于不同HPV型别、不同随访时间的HPV清除率分析数据。目前上述产品的上市申请已获国家药监局受理,尚需经过审评、药品临床试验现场检查、药品生产现场检查和审批等环节,上述产品能否成功上市及上市时间具有不确定性。
2024-11-05 17:32
【亚虹医药:灌注用盐酸氨酮戊酸己酯获批上市】亚虹医药公告,公司收到国家药监局核准签发的《药品注册证书》,批准公司APL-1706(灌注用盐酸氨酮戊酸己酯)上市。灌注用盐酸氨酮戊酸己酯用于膀胱癌(包括原位癌)患者的膀胱镜检查等。
2024-10-24 17:23
【亚虹医药:APL-2302临床试验申请获得FDA批准】亚虹医药公告,近日公司收到美国食品药品监督管理局(简称“FDA”)关于同意开展公司自主研发的APL-2302用于治疗晚期实体瘤临床试验的函告。APL-2302临床试验申请获FDA批准后,公司将尽快向中国国家药品监督管理局(NMPA)药品审评中心(CDE)递交新药临床试验申请(IND),积极推动该项临床试验在全球范围内的开展。本次APL-2302临床试验申请获得FDA批准事项对公司近期业绩不会产生重大影响。
2024-09-17 15:50
【亚虹医药:APL1702用于治疗HSIL的国际多中心Ⅲ期临床试验结果入选2024年国际光动力与光诊断大会】亚虹医药9月17日晚间公告,近日,公司产品APL1702用于治疗宫颈高级别鳞状上皮内病变(HSIL)的前瞻、随机、双盲、安慰剂对照的国际多中心Ⅲ期临床试验结果入选2024年国际光动力与光诊断大会,并以大会口头报告的形式发布该研究关于降低宫颈癌前病变组织病理学分级的疗效数据。来自中国、德国、荷兰等多个国家的402名符合条件的患者随机化后入组该研究。已完成的统计分析结果显示,该研究已达到主要疗效终点,安全性良好。
2024-06-24 18:52
【亚虹医药:APL-1202临床试验申请获批】亚虹医药公告,公司收到国家药监局签发的《药物临床试验批准通知书》,公司APL-1202用于治疗自由生活阿米巴(Free-living Amoebae,FLA)感染的临床试验申请获得批准。
2024-05-12 21:49
【亚虹医药:盐酸氨酮戊酸己酯软膏光动力治疗系统上市申请获得受理】亚虹医药公告,收到国家药品监督管理局核准签发的《受理通知书》,公司产品APL-1702(通用名:盐酸氨酮戊酸己酯软膏光动力治疗系统)拟用于治疗18岁及以上排除原位癌的经组织学证实的宫颈高级别鳞状上皮内病变(High-Grade Squamous Intraepithelial Lesion, HSIL)患者的上市申请获得受理。
2024-05-12 16:00
【亚虹医药:盐酸氨酮戊酸己酯软膏光动力治疗系统上市申请获得受理】5月12日电,亚虹医药公告,收到国家药品监督管理局核准签发的《受理通知书》,公司产品APL-1702(通用名:盐酸氨酮戊酸己酯软膏光动力治疗系统)拟用于治疗18岁及以上排除原位癌的经组织学证实的宫颈高级别鳞状上皮内病变(High-Grade Squamous Intraepithelial Lesion, HSIL)患者的上市申请获得受理。
2024-03-18 15:41
【亚虹医药:发布APL-1702用于治疗宫颈高级别鳞状上皮内病变的国际多中心Ⅲ期临床试验数据】《科创板日报》18日讯,亚虹医药公告,近日公司产品APL-1702用于治疗宫颈高级别鳞状上皮内病变的前瞻、随机、双盲、安慰剂对照的国际多中心Ⅲ期临床试验结果入选2024年欧洲生殖器官感染和肿瘤研究组织大会(EUROGIN)和2024年美国妇科肿瘤学会年会(SGO),并均以大会口头报告的形式发布本研究关于疗效和安全性的核心数据。
2024-03-18 15:40
亚虹医药:在2024年EUROGIN和SGO会议上发布APL-1702用于治疗宫颈高级别鳞状上皮内病变的国际多中心Ⅲ期临床试验数据。
2024-02-06 19:16
亚虹医药:拟以5000万元-1亿元回购股份,回购股份的价格不超过人民币12.80元/股
2024-02-04 17:50
【亚虹医药:APL-1202数据发布,未来将继续深耕膀胱癌领域拓展更多可能】亚虹医药公布APL-1202与化疗灌注联合使用二线治疗化疗灌注复发的中高危非肌层浸润性膀胱癌(NMIBC)的关键性临床试验数据显示公告,在部分患者人群中显示出一定的优效趋势,但试验未达到主要研究终点。除上述临床外,亚虹医药同时正在开展APL-1202其他临床试验。此前公司公布的APL-1202口服联合PD-1免疫抑制剂替雷利珠单抗作为肌层浸润性膀胱癌(MIBC)新辅助治疗的Ⅱ期临床试验已完成期中分析数据,并取得了积极结果。
2023-12-24 16:27
【亚虹医药:APL-2301在澳大利亚开展Ⅰ期临床试验获许可】亚虹医药公告,公司子公司MetCuraPharmaceuticals AUS Pty Ltd收到澳大利亚人类研究伦理委员会签发的关于批准公司开发的用于治疗鲍曼不动杆菌感染的产品APL-2301(此为更新后编号,原编号为ASN-1733)开展Ⅰ期临床试验的临床试验伦理许可。
2023-11-29 15:37
【亚虹医药:APL-1706用于膀胱癌诊断和管理的上市申请获得受理】《科创板日报》29日讯,亚虹医药公告,公司近日收到国家药品监督管理局核准签发的受理通知书,公司产品APL-1706(通用名:灌注用盐酸氨酮戊酸己酯)用于膀胱癌诊断和管理的上市申请获得受理。APL-1706是目前全球唯一获批的辅助膀胱癌诊断或手术的显影剂类药物,通过与蓝光膀胱镜的联合使用可以有效提高膀胱癌的检出率(尤其是原位癌(CIS)的检出率),使手术切除更完全,从而降低肿瘤复发率。
2023-11-29 15:36
亚虹医药:APL-1706用于膀胱癌诊断和管理的上市申请获得受理。
2023-10-28 07:17
【亚虹医药:2款核心产品近期申请上市】《科创板日报》10月28日讯,亚虹医药方面向《科创板日报》记者透露,公司将于近期与监管部门沟通递交核心产品APL-1706、APL-1702的新药上市申请事宜。据悉,APL-1706是目前全球唯一获批的辅助膀胱癌诊断或手术的显影剂类药物,通过与蓝光膀胱镜的联合使用可以有效提高膀胱癌的检出率,使手术切除更完全,从而降低肿瘤复发率。APL-1702是用于非手术治疗宫颈高级别鳞状上皮内病变(HSIL)的光动力药械组合产品,治疗过程简单,不影响患者日常生活,有望成为全球首个针对宫颈HSIL疗效确证的非手术产品。(记者 郑炳巽)
2023-10-12 16:15
【亚虹医药:发布APL-1706用于膀胱癌诊断的Ⅲ期临床试验数据】《科创板日报》12日讯,亚虹医药公告,在2023年国际泌尿外科学会年会(SIU)上发布APL-1706用于膀胱癌诊断的Ⅲ期临床试验数据。
2023-10-12 16:09
亚虹医药:在2023年国际泌尿外科学会年会(SIU)上发布APL-1706用于膀胱癌诊断的Ⅲ期临床试验数据
2023-09-20 19:49
【全球首个宫颈HSIL非手术类产品国际III期临床成功】《科创板日报》20日讯,近日,亚虹医药宣布,产品APL-1702的国际多中心III期临床试验达到主要研究终点。该产品用于非手术治疗宫颈高级别鳞状上皮内病变(HSIL),并有望成为全球首个针对宫颈HSIL的疗效确证的非手术类产品。亚虹医药将于近期与监管部门沟通,递交该产品的新药上市申请事宜。(记者 郑炳巽)
2023-09-20 15:36
亚虹医药:APL-1702用于治疗宫颈高级别鳞状上皮内病变的国际多中心Ⅲ期临床试验达到主要研究终点。
2023-09-14 15:43
【亚虹医药:APL-1401Ⅰb期临床试验完成首例受试者入组】9月14日电,亚虹医药公告,公司开展的APL-1401用于治疗中度至重度活动性溃疡性结肠炎的Ⅰb期临床试验,近日完成首例受试者入组。APL-1401是公司自主研发的一种全新机制治疗溃疡性结肠炎(UC)的口服创新药物。
2023-09-14 15:37
亚虹医药:APL-1401Ⅰb期临床试验完成首例受试者入组。
2023-09-13 16:03
亚虹医药:APL-1202口服联合替雷利珠单抗作为肌层浸润性膀胱癌(MIBC)新辅助治疗的Ⅰ/Ⅱ期临床试验完成Ⅱ期临床试验期中分析并取得积极结果
2023-08-29 19:24
【亚虹医药:APL-1401临床试验申请获批】8月29日电,亚虹医药公告,近日,公司收到国家药品监督管理局签发的《药物临床试验批准通知书》,公司自主研发的APL-1401临床试验申请获得批准,用于治疗溃疡性结肠炎。

 VIP复盘网
VIP复盘网