|
华海药业
600521 |
3.07%
|
最新:18.48
开盘:17.96 昨收:17.93 |
开盘%:0.17%
振幅%:3.85% 换手%:1.7% |
最高:18.65
最低:17.96 量比:1.83 |
总市值:271 亿
流通值:271 亿 成交额:15 亿 |
- 基本信息
- 个股快讯
- 上市公司
- 龙虎榜
- 历史涨停原因
- 董秘互动
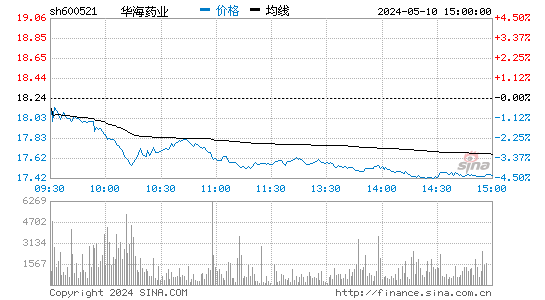
- 分时图
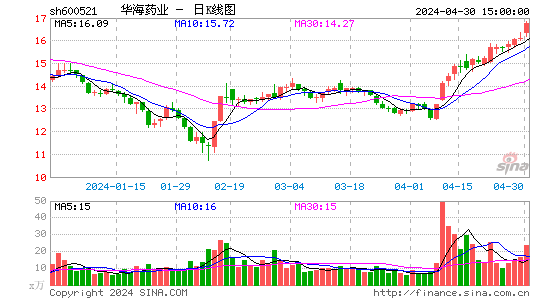
- 日K图
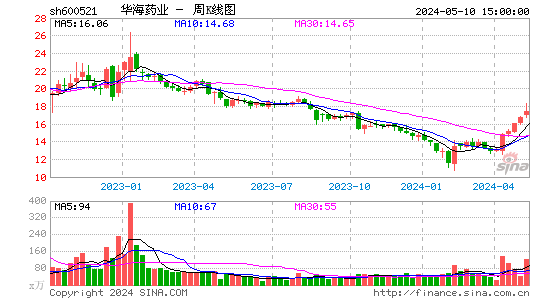
- 周K图
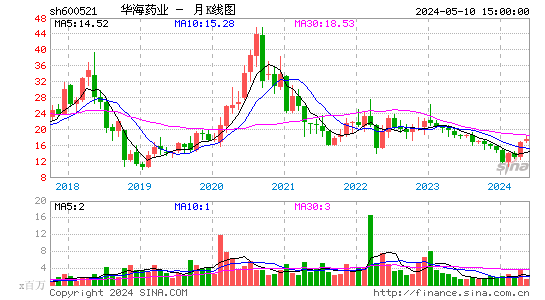
- 月K图
2024-10-28 17:14
【华海药业:布立西坦片获得美国FDA暂时批准文号】10月28日电,华海药业公告,公司收到美国FDA的通知,向美国FDA申报的布立西坦片的新药简略申请(ANDA)已获得暂时批准。布立西坦片主要用于治疗癫痫。
2024-10-24 15:30
【华海药业于上海成立药物研究公司 注册资本1亿元】企查查APP显示,近日,华海天衡(上海)药物研究股份有限公司成立,法定代表人为陈保华,注册资本为1亿元,经营范围包含:医学研究和试验发展;货物进出口;技术进出口;数据处理和存储支持服务;药品生产;药品进出口;药物临床试验服务等。企查查股权穿透显示,该公司由华海药业全资持股。
2024-10-21 17:21
【华海药业:获得阿加曲班注射液药品注册证书】10月21日电,华海药业公告,公司近日收到国家药监局核准签发的阿加曲班注射液的《药品注册证书》。该药品用于治疗缺血性脑梗死急性期病人的神经症状和日常活动改善,以及慢性动脉闭塞症患者的四肢溃疡、静息痛及冷感等改善。阿加曲班注射液获得注册证书,将进一步丰富公司产品线,提升市场竞争力,并对公司经营业绩产生积极影响。根据米内网数据预测,该药品2023年国内市场销售金额约人民币4.8亿元。公司已投入研发费用约人民币908万元。
2024-10-17 15:42
华海药业:制剂产品恩格列净二甲双胍片获得美国FDA暂时批准文号,标志着该产品通过了仿制药的所有审评要求。该产品需要在专利权到期并得到FDA最终批准后才能获得在美国市场销售的资格
2024-09-18 21:00
【华海药业:马来酸依那普利片等获得药品注册证书】华海药业公告,公司及下属控股子公司长兴制药近日收到国家药监局核准签发的关于马来酸依那普利片、阿立哌唑口服溶液的药品注册证书。马来酸依那普利片主要用于治疗各期原发性高血压,肾血管性高血压,各级心力衰竭,预防症状性心衰,预防左心室功能不全病人冠状动脉缺血事件。阿立哌唑口服溶液主要用于治疗13~17岁青少年和成人的精神分裂症。
2024-09-12 19:15
【华海药业:公司制剂产品白消安注射液获得美国FDA批准文号】9月12日电,华海药业公告,公司向美国FDA申报的白消安注射液的新药简略申请(ANDA)已获得批准且获得孤儿药认定。白消安注射液主要用于与环磷酰胺联合使用,作为慢性粒细胞白血病异基因造血祖细胞移植前的预处理方案。
2024-08-28 12:50
【上海暂停华海药业多巴丝肼片采购资格】8月28日电,据上海阳光医药采购网,华海药业生产的多巴丝肼片采购资格被暂停。上海市医药集中招标采购事务管理所提出,据《关于全面实施药品挂网公开议价采购的通知》(沪药事〔2018〕51号)、《关于进一步优化本市药品分类挂网全面议价采购有关事项的通知》(沪药事药品〔2022〕18号)等文件规定,暂停华海药业生产的多巴丝肼片(左旋多巴200mg与苄丝肼50mg(相当于盐酸苄丝肼57mg)*40片/盒,双铝包装)采购资格1年,通知自8月28日起正式执行。
2024-08-21 20:51
【华海药业:制剂产品替格瑞洛片获得美国FDA批准文号】华海药业(600521)8月21日晚间公告,近日,公司收到美国食品药品监督管理局(简称“美国FDA”)的通知,公司向美国FDA申报的替格瑞洛片(规格:90mg)的新药简略申请(ANDA,即美国仿制药申请)已获得正式批准,替格瑞洛片主要用于治疗血栓。
2024-07-19 16:49
【华海药业:子公司左乙拉西坦口服溶液获药品注册证书】华海药业(600521)7月19日晚间公告,公司下属控股子公司长兴制药股份有限公司近日收到国家药监局核准签发的左乙拉西坦口服溶液的《药品注册证书》。该药品主要用于成人、儿童及一个月以上婴幼儿癫痫患者部分性发作的加用治疗。
2024-07-16 17:50
【华海药业:富马酸喹硫平片获得药品注册证书】华海药业(600521)于7月16日晚间发布公告,公司近期获得国家药监局核准签发的富马酸喹硫平片《药品注册证书》。该药品用于治疗精神分裂症和双相情感障碍的躁狂发作。按照国家相关政策,富马酸喹硫平片被列为化学药品4类批准生产,这意味着它已经通过一致性评价。因此,医疗机构将优先采购和临床使用该药品,这将对公司的经营业绩产生积极的影响。
2024-07-08 17:04
【华海药业:子公司获药物临床试验许可】7月8日电,华海药业公告,子公司华奥泰和华博生物收到国家药监局核准签发的HB0046注射液的药物临床试验批准通知书,适应症为晚期实体瘤。
2024-07-05 17:21
【华海药业:奥美沙坦酯氨氯地平片获药品注册证书】7月5日电,华海药业公告,公司近日收到国家药监局核准签发的奥美沙坦酯氨氯地平片的《药品注册证书》。奥美沙坦酯氨氯地平片用于治疗原发性高血压。根据米内网数据预测,奥美沙坦酯氨氯地平片2023年国内市场销售金额约人民币4.87亿元。
2024-07-04 18:33
【华海药业:2024年半年度净利润预增约28%到38%】华海药业公告,经财务部门初步测算,2024年半年度实现归属于上市公司股东的净利润预计在72800万元至78500万元之间,同比增加约28%到38%。扣除非经常性损益的净利润预计在74500万元至81000万元之间,同比增加约15%到25%。业绩增长主要由于新产品导入、市场拓展成效显现、销售团队及组织架构调整、市场占有率提升、销售收入大幅增长以及精益管理优化等因素。
2024-07-02 16:31
【华海药业:利伐沙班片获得美国FDA暂时批准文号】7月2日电,华海药业公告,公司向美国FDA申报的利伐沙班片的新药简略申请(ANDA,即美国仿制药申请)已获得暂时批准。利伐沙班片主要用于血栓的治疗及预防。2023年该药品美国市场销售额约82.81亿美元。
2024-06-14 16:47
【华海药业:子公司长兴制药终止北交所辅导备案】华海药业公告,公司子公司长兴制药是全国中小企业股份转让系统挂牌企业(证券简称:长兴制药,证券代码:835269)。公司近日接到长兴制药通知,浙江证监局于2024年6月14日确认长兴制药终止辅导。
2024-06-13 16:49
【华海药业:注射用盐酸表柔比星获药品注册证书】6月13日电,华海药业公告,注射用盐酸表柔比星获得国家药监局的《药品注册证书》。注射用盐酸表柔比星用于治疗恶性淋巴瘤、乳腺癌、肺癌、软组织肉瘤、食道癌、胃癌、肝癌、胰腺癌、黑色素瘤、结肠直肠癌、卵巢癌、多发性骨髓瘤、白血病等。
2024-05-29 15:45
华海药业:获得甲磺酸雷沙吉兰片药品注册证书
2024-04-29 17:24
华海药业:下属子公司获得注射用HB0052药物临床试验许可
2024-04-23 17:57
华海药业:获得白消安注射液药品注册证书
2024-04-19 16:40
【华海药业:公司及相关人员收到浙江证监局警示函】4月19日电,华海药业公告,公司于近日收到浙江证监局出具的行政监管措施决定书,公司董事长李宏、总经理陈保华、首席财务官张美、董事会秘书祝永华违反相关规定,对上述违规行为承担主要责任。根据相关规定,浙江证监局决定对公司及上述相关人员分别采取出具警示函的监督管理措施,并记入证券期货市场诚信档案。
2024-04-16 16:11
华海药业:获得托拉塞米片药品注册证书
2024-04-15 17:21
华海药业:预计一季度净利润2.6亿元-2.9亿元,同比增加约50%到65%
2024-03-22 16:29
华海药业:获得托拉塞米注射液药品注册证书。
2024-03-04 16:36
【全国人大代表、华海药业总裁陈保华:建议抓紧出台生物制品药物分段生产相关法规和指南】3月4日电,全国人大代表、华海药业总裁陈保华建议,国家抓紧出台生物制品药物分段生产相关法规和指南。他建议,在对持有人以及生产场地的监管上,规定境外或境内的持有人和生产场地均可实施生物制品分段生产;在委托生产的药品范围上,明确规定一般药物的委托生产加工法规或指南文件,也适用于疫苗和其他生物制品;在委托生产的管理上,委托方需符合GMP及其他相关法律法规要求,持有人负责最终产品的上市放行,持有人有权对受托生产企业的设施开展GMP符合性审计;对完成度较好的生物制品药物的分段生产“先行、先试”积累经验,并逐步开放创新型生物制品药物的分段生产,不断满足国内生物制品分段生产的需求,补齐相应制度短板。(记者 陈骁宇)

 VIP复盘网
VIP复盘网